
ISO13485とは?
ISO13485とは「医療機器の品質マネジメントシステムに関する国際規格」のことです。
ISO9001が「品質マネジメントシステムに関する国際規格」のことですから、ISO13485は、
ISO9001の要求事項に細かい決まりを追加した医療機器バージョンのことなのです。
ISO9001については、このホームページの「なぜ、今、ISO9001が必要か?」を参照していただくとして、ISO13485は「医療機器を、開発、製造、販売するときは、このようにやりなさい」ということが、国際的なルールとして定められているのです。
ISO9001が「現代における企業経営は、こうやった方が良いよ」といった、ある程度の裁量範囲を認めて自主的な取り組みを推奨していることに対し、ISO13485は、「医療機器を、開発、製造、販売するときは、このようにやりなさい」といった制限的・規制的な意味合いが強くなっています。
そのため、規格の正式名称も「医療機器-品質マネジメントシステム 規制目的のための要求事項」となっているのです。
なぜ、ISO9001と違い、ISO13485はこのような規格になっているのでしょうか?
それは、ISO13485が「法律で使う規格」だからです。
ISO13485は、ISO9001やISO14001と違い、各国の医療機器の製造業者を規制する法律に組み込まれることが、ISO13485の目的なのです。
実際に、ヨーロッパ、カナダ、オーストラリアなど、ほとんどの国で、このISO13485の要求に基づいて医療機器を規制する法律が作られています。
アメリカ合衆国は、独自の規制体系ですが、内容はISO13485と共通するものになっています。
では、日本では、どのようになっているのでしょうか?
ご存知のように、2005年(平成17年)4月に改正薬事法が改正され、医療機器の個別製品の承認制度と製造販売に関する制度が変わりました。その結果。医療機器の製造業に対する許可要件である「製造管理及び品質管理基準(GMP)」も、ISO13485に準拠した内容に改定されています。
こうしたことから、日本国内のみの製造販売だけを考えていれば、ISO13485の認証取得は必要ありません。GMPにだけ適合しておけばよいのです。
しかし、製造した医療機器を輸出するときには、GMPに適合しているだけでは輸入する相手国が認めてくれません。ヨーロッパ各国はもちろんのこと、最近はアジア各国でも、ISO13485が、医療機器の輸入販売条件として、製造業者に課せられつつあります。
ここでISO13485の認証取得が必要になってくるのです。
何をすればISO13485は取得できる?
では、どうすればISO13485を認証取得できるのでしょうか?
ISO13485は、ISO9001の要求事項に細かい決まりを追加した医療機器バージョンですから、基本的にISO9001の考え方がしっかりと解っていれば、それ程は難しくないはずです。また、既に日本国内でGMPに適合した製品を製造しているのであれば、ISO13485の基本的な考え方は、もう、既にあるはずです。
つまり、ISO13485とは、ISO9001にGMPの考え方を合体させたものと考えると解りやすいと思います。そして、その管理の程度は、ISO13485には、具体的には決められていませんので、医療機器のカテゴリー(表1参照)に分類される医療機器製品がもつリスクのレベルに合わせて決めていきます。この時、ISO13485の適用範囲となる対象製品は、一部の製品だけとする事も可能です。
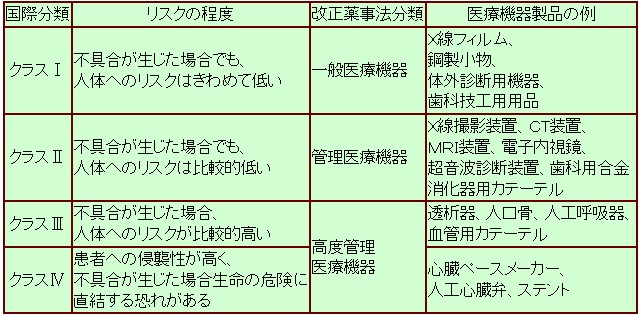
さて、ISO13485はISO9001とGMPの2つの側面を併せ持つ規格といえます。つまり、
①ISO9001で要求される「会社全体の経営管理の仕組み」
②GMPで要求される「医療機器の管理の仕組み」
です。「会社全体の経営管理」と「個別の医療機器の管理」の2つを要求されるので、少し複雑といえます。
しかし、ここでも超コンパクトISOの考え方が使えます。よく考えてみてください。
「会社全体の経営管理」と「個別の医療機器の管理」では、どちらが上位概念でしょうか?
当然ながら「会社全体の経営管理」です。
これに、具体的な「個別の医療機器の管理」の仕組みをうまく組み合わせてやればいいのです。
この時、ISO13485規格の意味をよく解っていないと、非常にアンバランスな、わかりにくい仕組みになってしまいます。
例えば、ISO13485では、ISO9001の次の事項が下記のように変更されています。
①「継続的改善」⇒「有効性の維持」
②顧客の「満足」の概念が無くなった
これは、ISO13485が「法律で使う規格」だから発生した事象なのです。つまり、法律には、努力目標的な「継続的改善」や顧客の主観による「満足」は、あいまいなので不要だという考えなのです。
しかし、実際の経営や生産現場に当てはめたときはどうでしょう。少しでも不良を無くして生産性を向上させるための努力をすると思いますし、より良い製品をお客さんに提供して、お客さんに喜んでもらうようにすると思います。ですから「継続的改善」や「顧客満足」を優先して仕組みを構築した方が、システムがうまく生きると思われます。
このように、ISO13485に基づく品質マネジメントシステム構築は、「会社全体の経営管理」と「個別の医療機器の管理」の部分を上手に切り分けながら、「医療機器に対する規制を順守しつつ、経営に役に立つと仕組みにすること」が大切になってきます。
ISO13485のコンサルタントの必要要件は?
ISO13485の規格書を読むと、何度となく「国及び地域の法令が~」と言う言葉が出てきます。
この「国及び地域の法令が~」とは、日本が定める法律、つまり改正薬事法を意味します。
ISO13485でコンサルタントに求められる知識は「改正薬事法の内容を良く知っていること」が条件になります。
アイソ・ラボでは、ISO13485の取得を支援するコンサルタントの要件として、ISO9001の知識に加えて「薬機法を理解していること」を絶対条件としています。弊社のコンサルタントには、大手製薬会社に勤務し薬機法を学んだものが所属しています。どうぞご安心下さい。
ISO13485を取得するにあたりアイソ・ラボの支援を受けたい、見積書が欲しい場合は、お気軽にお問合せ下さい。
あなた様からの見積依頼をお待ちしております。
アイソ・ラボ株式会社
